以每次一個分子的方式研究整個基因組
當前位置:首頁 >> 儀器儀表技術(shù)文章
以每次一個分子的方式研究整個基因組
摘要:基因組學(xué)新近的進展為生物學(xué)的發(fā)現(xiàn)創(chuàng)造了巨大的機遇,抓住這個機遇需要新穎的試驗設(shè)計以及高通量的數(shù)據(jù)收集和分析系統(tǒng)。隨著基因分析系統(tǒng)的靈活性和綜合能力的增強,能夠進行單細胞和單分子檢測、適用于整個基因組、并且能夠高通量的產(chǎn)生和處理巨大的數(shù)據(jù)平臺的構(gòu)建成為一種重要的趨勢。由Wisconsin-Madison, WI大學(xué)構(gòu)建Optical Mapping(可見圖譜)系統(tǒng)便是這些新穎的平臺之一,它能夠以每次一個分子的方式研究整個基因組。
基因組學(xué)新近的進展為生物學(xué)的發(fā)現(xiàn)創(chuàng)造了一個巨大的充滿機遇的舞臺。抓住這個機遇需要新穎的試驗設(shè)計、高通量的數(shù)據(jù)收集和分析系統(tǒng)以及富有創(chuàng)造性的方法去解決以前難以理解的問題。隨著基因分析系統(tǒng)的靈活性及綜合能力的增強,能夠進行單細胞和單分子檢測、適用于整個基因組、并且能夠高通量的產(chǎn)生巨大的數(shù)據(jù)平臺的構(gòu)建正在成為一種重要的趨勢。Optical Mapping(可見圖譜)系統(tǒng)(University of Wisconsin-Madison, WI)作為這類新穎平臺的一例,能夠以每次一個分子的方式研究整個基因組。 電阻計 | 紅外線測溫儀 | 紅外線溫度計 | 頻譜分析儀 | 鉤表 | 多功能測試儀 | 電容表 | 記錄儀 | 色度計 | 剝線鉗 | 電壓計 | 濁度計 | 溫濕度記錄儀
Optical Mapping 系統(tǒng)通過收集單個分子的圖譜形成整個基因組的物理圖譜。而這些物理圖譜在基因組中能夠反映特殊DNA 序列的位置以及它們之間的物理距離。在插入、刪除、倒置、復(fù)制、顛換和重排方面,它們所進行的表征和比較對基因組非常有用[1]。通過創(chuàng)造性地結(jié)合DNA 分子的預(yù)處理和操作、表面化學(xué)、高速數(shù)據(jù)收集成像以及一系列的選擇性處理過程,OpticalMapping 便產(chǎn)生出物理圖譜,這些物理圖譜的特征便是能為基因組學(xué)長期存在的問題提供新的解決辦法。例如,Optical Mapping 的單分子檢測功能使得它可以對不同種類的群體進行基因水平上的分析,比如實性瘤(solid tumor)內(nèi)或者在細菌菌落里的分子的檢測。從細胞中提取出的DNA 分子可直接成像,而不需要擴增和亞克隆步驟。因此基因的每一部位都可經(jīng)Optical Mapping直接觀測,使得這一系統(tǒng)成為一個真正的全基因方法。就此而言,Optical Mapping 系統(tǒng)與那些建立在整個染色體上進行基因比較的低分辨率的細胞遺傳方法具有相似之處。但是,OpticalMapping 的分辨率可以達到幾萬個堿基,這使得該方法適合于低分辨方法辨基因型方法未曾被探索過的領(lǐng)域的研究。分辨率在幾千個堿基的全基因分析方法開啟了以前難以解決的基因變異問題之門,例如:對中等到大的片段插入和缺失的檢測和翻譯。更重要的是,通過Optical Mapping 檢測基因組多態(tài)性不需要預(yù)先知道諸如基因的類型、位置等信息,使得這一方法成為名副其實的“發(fā)現(xiàn)型方法”。最后,Optical Mapping系統(tǒng)的通量相當于在90min 內(nèi)收集代表一個人基因組的數(shù)據(jù),如此大的通量也使得對于大范圍群體的研究成為可能。在那種條件下,通過疾病敏感性和藥物響應(yīng)性基因座位鑒定的相關(guān)研究,整個人類基因組的全部變異都能被直接區(qū)分。下文中,作者會通過詳細地描述Optical Mapping 系統(tǒng),列舉出該技術(shù)應(yīng)用的典型實例,并把該技術(shù)置于現(xiàn)有基因分析平臺之中來詳細闡述Optical Mapping 的特點。
Optical Mapping 系統(tǒng)通過收集單個分子的圖譜形成整個基因組的物理圖譜。而這些物理圖譜在基因組中能夠反映特殊DNA 序列的位置以及它們之間的物理距離。在插入、刪除、倒置、復(fù)制、顛換和重排方面,它們所進行的表征和比較對基因組非常有用[1]。通過創(chuàng)造性地結(jié)合DNA 分子的預(yù)處理和操作、表面化學(xué)、高速數(shù)據(jù)收集成像以及一系列的選擇性處理過程,OpticalMapping 便產(chǎn)生出物理圖譜,這些物理圖譜的特征便是能為基因組學(xué)長期存在的問題提供新的解決辦法。例如,Optical Mapping 的單分子檢測功能使得它可以對不同種類的群體進行基因水平上的分析,比如實性瘤(solid tumor)內(nèi)或者在細菌菌落里的分子的檢測。從細胞中提取出的DNA 分子可直接成像,而不需要擴增和亞克隆步驟。因此基因的每一部位都可經(jīng)Optical Mapping直接觀測,使得這一系統(tǒng)成為一個真正的全基因方法。就此而言,Optical Mapping 系統(tǒng)與那些建立在整個染色體上進行基因比較的低分辨率的細胞遺傳方法具有相似之處。但是,OpticalMapping 的分辨率可以達到幾萬個堿基,這使得該方法適合于低分辨方法辨基因型方法未曾被探索過的領(lǐng)域的研究。分辨率在幾千個堿基的全基因分析方法開啟了以前難以解決的基因變異問題之門,例如:對中等到大的片段插入和缺失的檢測和翻譯。更重要的是,通過Optical Mapping 檢測基因組多態(tài)性不需要預(yù)先知道諸如基因的類型、位置等信息,使得這一方法成為名副其實的“發(fā)現(xiàn)型方法”。最后,Optical Mapping系統(tǒng)的通量相當于在90min 內(nèi)收集代表一個人基因組的數(shù)據(jù),如此大的通量也使得對于大范圍群體的研究成為可能。在那種條件下,通過疾病敏感性和藥物響應(yīng)性基因座位鑒定的相關(guān)研究,整個人類基因組的全部變異都能被直接區(qū)分。下文中,作者會通過詳細地描述Optical Mapping 系統(tǒng),列舉出該技術(shù)應(yīng)用的典型實例,并把該技術(shù)置于現(xiàn)有基因分析平臺之中來詳細闡述Optical Mapping 的特點。
1 實驗
在Optical Mapping 中,大的基因組DNA分子(300-3000kb 堿基)直接從細胞中提取、延伸,并通過結(jié)合微流控芯片技術(shù)[2]和帶正電的玻璃表面與帶負電的DNA 骨架之間的靜電相互作用使其固定在被特殊處理的玻璃表面上(圖1)。這種固定化技術(shù)相當精妙,以至限制性內(nèi)切酶仍很容易接近DNA分子,而且產(chǎn)生的限制型片段也能得到很強的保留。可切割6000~45000 個堿基對的限制性內(nèi)切酶能夠用于制作高分辨率的物理圖譜。熒光染料YOYO-1能夠標記表面上的DNA骨架,其形成的單分子圖譜的納米陣列可通過熒光顯微鏡進行觀測。

不管亞微觀的DNA 分子的實際寬度是多少,熒光顯微鏡的數(shù)值放大功能使得DNA 分子的寬度有一個明顯的增加,這樣,被拉長的單鏈DNA 分子可很容易地通過標準的63×物鏡觀測到。大的、被拉長的DNA 分子的性質(zhì)與拉長的彈簧相似,當它們緊緊黏附在限制性內(nèi)切酶上,只有分子的末端保持松弛狀態(tài),各個分子之間便形成可以識別的1~2μm 的間隙。與大多數(shù)的熒光系統(tǒng)通過添加探針分子進行標記不同,Optical Mapping 以分子間熒光的消失作為標記。添加的探針分子通常會在標簽周圍產(chǎn)生模糊圖案(由于傳統(tǒng)的探針非特異雜交),產(chǎn)生相應(yīng)的噪音。而這種方法不僅可以避免噪聲的產(chǎn)生,也省去了后續(xù)的探針去除步驟。由于限制性內(nèi)切酶具有特異性好和可預(yù)測的特點,Optical Mapping 可以保證物理圖譜形成過程簡單、準確。
快速數(shù)據(jù)收集通過一個可測定納米陣列OpticalMapping 的面積的成像系統(tǒng)實現(xiàn)。與其他物理圖譜方法不同,Optical Mapping 不需要知道碎片大小和序列信息。通過測量已知大小的DNA分子總的熒光強度,基于熒光強度隨堿基對的變化即可以得到Optical Mapping 的碎片大小。盡管DNA 分子輪廓長度發(fā)生了變化,熒光強度仍保持一致,使得碎片大小測量仍很準確。由于D N A 碎片通過靜電作用被固定在玻璃表面上,因此可實現(xiàn)單個分子限制性圖譜的繪制。
所有的單分子圖譜組合在一起形成一個包含整個染色體的圖譜,這一過程類似于序列的組裝。與其他物理圖譜不同,全基因Optical Mapping,又稱“一致”圖譜,綜合了成千上萬的單分子圖譜。“一致”圖譜上一個典型的基因座位覆蓋了10~70 個單分子圖譜。這么大的覆蓋率使得Optical Mapping 比起其他的物理圖譜技術(shù)有更高的準確性[3-9]。由于每個DNA 分子都能產(chǎn)生一系列離散的數(shù)據(jù)(限制性酶切碎片圖譜),因而任何一個(或者每一個)DNA 分子產(chǎn)生的數(shù)據(jù)相當于瓊脂糖凝膠上的一條完整的帶或者微陣列中的一個點(見表1 )。這樣,Optical Mapping 系統(tǒng)在一塊芯片上產(chǎn)生一系列大量的類似數(shù)據(jù),該方法的準確性和精確性已被上千次的實驗所證實。
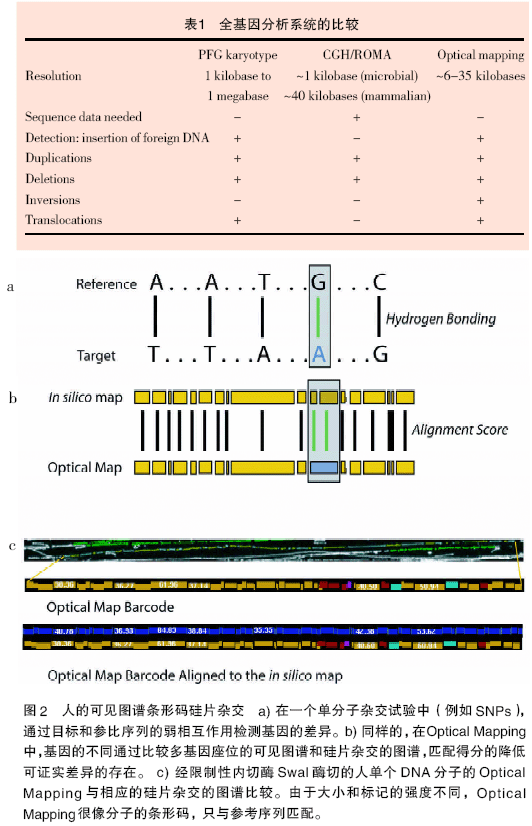
根據(jù)分析的目的,“一致”圖譜和單分子Optical Mapping 都可以通過硅片雜交定位到相應(yīng)的序列。就像掃描條形碼鑒定物質(zhì)一樣(圖2),通過掃描限制性碎片形成的Optical Mapping 圖案(而不是在硅片上的圖譜的圖案)鑒定圖譜相應(yīng)的序列,進而可指認其在基因上的位置。在微陣列雜交試驗中,堿基之間的氫鍵反映相應(yīng)的目標和參考序列的匹配性,熒光強度的偏差表征多態(tài)性區(qū)域。同樣,在硅片雜交中限制性碎片之間的得分可以反映Optical Mapping 和硅片圖譜匹配的程度,而得分減少可表征多態(tài)性區(qū)域。硅片雜交的參數(shù)能被調(diào)整,從而使Optical Mapping 的條形碼與序列準確地對應(yīng)起來,但是也能很自由地檢測染色體的區(qū)別。
快速數(shù)據(jù)收集通過一個可測定納米陣列OpticalMapping 的面積的成像系統(tǒng)實現(xiàn)。與其他物理圖譜方法不同,Optical Mapping 不需要知道碎片大小和序列信息。通過測量已知大小的DNA分子總的熒光強度,基于熒光強度隨堿基對的變化即可以得到Optical Mapping 的碎片大小。盡管DNA 分子輪廓長度發(fā)生了變化,熒光強度仍保持一致,使得碎片大小測量仍很準確。由于D N A 碎片通過靜電作用被固定在玻璃表面上,因此可實現(xiàn)單個分子限制性圖譜的繪制。
所有的單分子圖譜組合在一起形成一個包含整個染色體的圖譜,這一過程類似于序列的組裝。與其他物理圖譜不同,全基因Optical Mapping,又稱“一致”圖譜,綜合了成千上萬的單分子圖譜。“一致”圖譜上一個典型的基因座位覆蓋了10~70 個單分子圖譜。這么大的覆蓋率使得Optical Mapping 比起其他的物理圖譜技術(shù)有更高的準確性[3-9]。由于每個DNA 分子都能產(chǎn)生一系列離散的數(shù)據(jù)(限制性酶切碎片圖譜),因而任何一個(或者每一個)DNA 分子產(chǎn)生的數(shù)據(jù)相當于瓊脂糖凝膠上的一條完整的帶或者微陣列中的一個點(見表1 )。這樣,Optical Mapping 系統(tǒng)在一塊芯片上產(chǎn)生一系列大量的類似數(shù)據(jù),該方法的準確性和精確性已被上千次的實驗所證實。
根據(jù)分析的目的,“一致”圖譜和單分子Optical Mapping 都可以通過硅片雜交定位到相應(yīng)的序列。就像掃描條形碼鑒定物質(zhì)一樣(圖2),通過掃描限制性碎片形成的Optical Mapping 圖案(而不是在硅片上的圖譜的圖案)鑒定圖譜相應(yīng)的序列,進而可指認其在基因上的位置。在微陣列雜交試驗中,堿基之間的氫鍵反映相應(yīng)的目標和參考序列的匹配性,熒光強度的偏差表征多態(tài)性區(qū)域。同樣,在硅片雜交中限制性碎片之間的得分可以反映Optical Mapping 和硅片圖譜匹配的程度,而得分減少可表征多態(tài)性區(qū)域。硅片雜交的參數(shù)能被調(diào)整,從而使Optical Mapping 的條形碼與序列準確地對應(yīng)起來,但是也能很自由地檢測染色體的區(qū)別。
2 應(yīng)用
2.1 從源頭進行基因組的構(gòu)建
2.1 從源頭進行基因組的構(gòu)建
基因組測序依賴于精確的物理圖譜來形成和驗證序列數(shù)據(jù)[1]。傳統(tǒng)的全基因物理圖譜通過酶切代表性的人工細菌染色體文庫(BAC),以及綜合產(chǎn)生的限制性片段組合成對應(yīng)的基因組序列。現(xiàn)有技術(shù)如“高信息量指紋圖譜“(HICF)[10]極大地改進了以BAC 為基礎(chǔ)的物理圖譜的分辨率和準確度。可是以BAC 為基礎(chǔ)的技術(shù)由于對橋連大的局部重復(fù)的DNA 分子有困難,需要深入的染色體文庫構(gòu)建,并且單個樣品需要很大的勞動強度,因而使得這一技術(shù)的優(yōu)勢被部分掩蓋。
Optical Mapping 不僅不存在上述問題,而且極大地簡化了物理圖譜的形成過程。HICF 形成的指紋圖譜沒有碎片的序列信息,只是在一個克隆過程中形成的大量的無序碎片。大的DNA 分子被酶切成規(guī)則的并具有豐富信息的限制性碎片,而并非簡單的指紋圖譜。
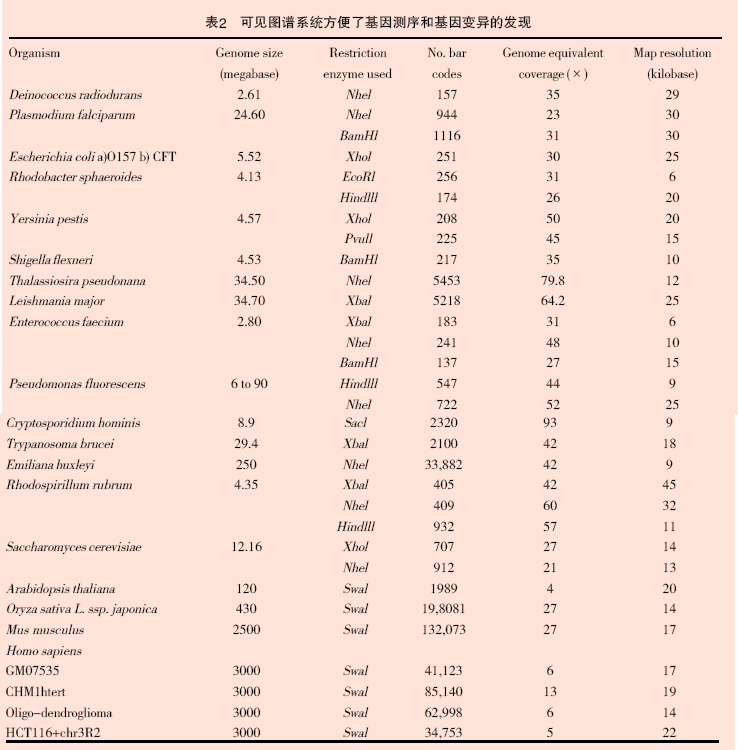
Optical Mapping 除了用于表2 給出的基因組研究外,也被用于輔助其他測序過程,及對一些生物的基因水平研究(耐輻射球菌、惡性瘧原蟲、大腸桿菌、白色念珠菌、紅螺菌、鼠疫桿菌、弗氏志賀氏菌、海鏈藻、利什曼原蟲等)[3,6,7,11-15]。這些研究證實了通過Optical Mapping 系統(tǒng)構(gòu)建物理圖譜的精確性和穩(wěn)定性。
Optical Mapping 不僅不存在上述問題,而且極大地簡化了物理圖譜的形成過程。HICF 形成的指紋圖譜沒有碎片的序列信息,只是在一個克隆過程中形成的大量的無序碎片。大的DNA 分子被酶切成規(guī)則的并具有豐富信息的限制性碎片,而并非簡單的指紋圖譜。
Optical Mapping 除了用于表2 給出的基因組研究外,也被用于輔助其他測序過程,及對一些生物的基因水平研究(耐輻射球菌、惡性瘧原蟲、大腸桿菌、白色念珠菌、紅螺菌、鼠疫桿菌、弗氏志賀氏菌、海鏈藻、利什曼原蟲等)[3,6,7,11-15]。這些研究證實了通過Optical Mapping 系統(tǒng)構(gòu)建物理圖譜的精確性和穩(wěn)定性。
2.2 發(fā)現(xiàn)插入缺失的比較基因組學(xué)研究
Optical Mapping 系統(tǒng)不需要預(yù)先知道基因組的序列或結(jié)構(gòu),因此能很方便地比較相關(guān)的種類和分析來自同一物種中不同成員的多形態(tài)基因組。最近, 未經(jīng)測序的Shigella flexneri Y血清型菌株的Optical Mapping 被構(gòu)建出來,并與已測序的Shigella菌株的硅片圖譜進行比較。在未測序的Y 血清型菌株中發(fā)現(xiàn)了明顯的刪除現(xiàn)象,包括葡糖轉(zhuǎn)移酶gtrII、gtrAI 和gtrBI,這些轉(zhuǎn)移酶可能包含在血型的變化過程中[13]。近來的研究強調(diào)基因改變過程中的插入和刪除作用( i n d e l s )[16] 。用于檢測indels 的完善系統(tǒng)還處于研究的初期,而推測indels 在人類基因組學(xué)中的作用和影響基于高分辨率或者低分辨率的基因組學(xué)方法。Optical Mapping 對人類基因組學(xué)的重要貢獻便是發(fā)現(xiàn)了indels以及其他相似的現(xiàn)象如倒置、置換、復(fù)制和重排等,而其他高通量的基因組學(xué)平臺很難達到如此高的分辨率。
2.3 基因組異常的完善檢測方法
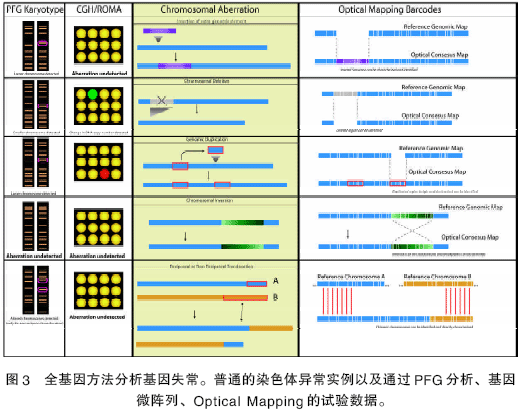
比較基因組雜交技術(shù)(CGH)和代表性的低聚核苷酸微陣列分析技術(shù)(ROMA)采用DNA 微陣列檢測微生物和哺乳動物基因組中DNA 拷貝數(shù)目的改變(圖3)[17,18],這些方法也能夠檢測復(fù)制和刪除的存在。可是,這些現(xiàn)象確切的本質(zhì)還不很清楚。擴增區(qū)的基因位置不能明確地被標識出來,特別是哺乳動物的基因組,低分辨率的CGH 和ROMA 不能準確地測定斷裂點的位置。此外,染色體中基因組外物質(zhì)的移位和插入不能被完全檢測。盡管脈沖場凝膠電泳(PFGE)[19]能夠檢測到諸如轉(zhuǎn)移等反常現(xiàn)象,但是對哺乳動物的基因組則需要預(yù)先知道斷裂點及其DNA 印跡;然而低等真核生物能以denono 模式直接檢測染色體的異常現(xiàn)象。另一方面,Optical Mapping 系統(tǒng)能夠直接分析這些異常的染色體,并且可精確檢測和定位基因斷裂點的位置,闡明遷移過程??通過成對的單分子限制性圖譜或者條形碼而非參考基因組。單分子圖譜本質(zhì)上講是雜交的圖譜而非硅片圖譜,它們通過序列數(shù)據(jù)構(gòu)建而成,這些很像硅片DNA 印跡法,只不過這些探針用于校準或者雜交過程。與所有的限制性圖譜一樣,已完成的Optical Mapping 的分辨率很容易通過選擇限制性內(nèi)切酶的切割頻次來調(diào)整。
3 結(jié)論
Optical Mapping 正從根本上迅速改變基因分析的方法和結(jié)果。該技術(shù)的特點??諸如單分子檢測、高通量、全基因研究的策略,為基因組學(xué)研究開辟了新的“ 戰(zhàn)場”。未來的研究工作將集中在人類基因組的Optical
Mapping,以及改進該系統(tǒng),增加其適應(yīng)性方面。例如,由于Optical Mapping的底物分子仍具有生物學(xué)活性,經(jīng)探針標記的二級雜交能被利用產(chǎn)生全基因范圍基礎(chǔ)上的外遺傳現(xiàn)象。發(fā)展“ 可見測序(Optical Sequencing)”會對單分子Optical Mapping 圖3 全基因方法分析基因失常。普通的染色體異常實例以及通過PFG分析、基因微陣列、Optical Mapping 的試驗數(shù)據(jù)。方法產(chǎn)生杠桿作用,從而使分辨率降低到幾個堿基對的水平[20,21]。越來越多基因信息的發(fā)現(xiàn),更多的問題也會產(chǎn)生。作者非常樂觀地認為Optical Mapping 系統(tǒng)能在將來探索和解決這些問題過程中做出貢獻。
Optical Mapping 正從根本上迅速改變基因分析的方法和結(jié)果。該技術(shù)的特點??諸如單分子檢測、高通量、全基因研究的策略,為基因組學(xué)研究開辟了新的“ 戰(zhàn)場”。未來的研究工作將集中在人類基因組的Optical
Mapping,以及改進該系統(tǒng),增加其適應(yīng)性方面。例如,由于Optical Mapping的底物分子仍具有生物學(xué)活性,經(jīng)探針標記的二級雜交能被利用產(chǎn)生全基因范圍基礎(chǔ)上的外遺傳現(xiàn)象。發(fā)展“ 可見測序(Optical Sequencing)”會對單分子Optical Mapping 圖3 全基因方法分析基因失常。普通的染色體異常實例以及通過PFG分析、基因微陣列、Optical Mapping 的試驗數(shù)據(jù)。方法產(chǎn)生杠桿作用,從而使分辨率降低到幾個堿基對的水平[20,21]。越來越多基因信息的發(fā)現(xiàn),更多的問題也會產(chǎn)生。作者非常樂觀地認為Optical Mapping 系統(tǒng)能在將來探索和解決這些問題過程中做出貢獻。
發(fā)布人:2012/9/1 10:45:001268
發(fā)布時間:2012/9/1 10:45:00
此新聞已被瀏覽:1268次
更多相關(guān)信息
分類點擊排行
- 1500米防水溫度記錄儀MX2204 HOBO TidbiT MX Tempe 5000
- HOBO無線藍牙水下溫度記錄儀MX2203 TidbiT MX
- MX2201新款帶藍牙水下溫度記錄儀Pendant MX Temp
- 防火報警智能熱像Fotric816/Fotric826
- 工程師通用熱像儀Fotric 222s/Fotric 222s-1/Fotric 222s-2
- HOBO MX100藍牙溫度記錄儀防水等級IP67
- 可程式噪音計TES-1352S帶記錄可插SD卡
- 數(shù)據(jù)記錄型照度光量子計TES-1339P
- 便攜一體式溫濕度大氣壓力計TES-1160/TES-1161
- 高精度水位計MX2001-04-s帶無線數(shù)據(jù)傳輸


